Broschüren und Flyer
Reiternavigation
Molekulare Biotechnologie
Forschung und Entwicklung für unsere Kunden

Als Basis der Bioökonomie trägt die Biotechnologie nachhaltig zur wissensbasierten Erzeugung und Nutzung biogener Rohstoffe in der Industrie bei. Wir etablieren bedarfsoptimierte Pflanzen und Mikroben für verschiedene Anwendungen: Für die Produktion von Nahrungsmitteln und nachwachsenden Rohstoffen, technischen und pharmazeutischen Proteinen sowie für den Umgang mit anthropogen erzeugten Schadstoffen wie klimaschädlichen Gasen, die wir zur Herstellung wertvoller Stoffe erschließen. Durch Synergien unserer Aktivitäten im Bereich der Grünen und Weißen Biotechnologie haben wir uns in der Forschungslandschaft und am Markt erfolgreich etabliert und bieten unseren Partnern in Behörden, Akademia und Industrie ein umfassendes Forschungs- und Dienstleistungsangebot.
Bioprozessentwicklung
Beratung und Expressions-Screening, Proteinreinigung, Prozessmodellierung
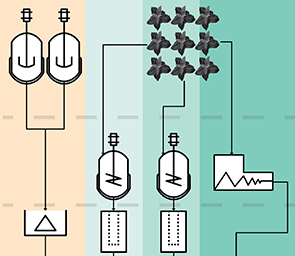
Die Biotechnologie ist eine Schlüsseltechnologie des 21. Jahrhunderts. Biotechnologische Produkte verändern bereits heute unser Leben: Als aktive pharmazeutische Inhaltsstoffe (APIs) in neuen Medikamenten, die die Behandlung von Krankheiten wie Krebs erleichten. Biopharmazeutika machen inzwischen 30 Prozent aller neu zugelassenen Medikamente aus, sie müssen aber vor dem Markteintritt einen umfangreichen Entwicklungsprozess durchlaufen. Obwohl solche Prozesse verschiedene Schritte und Operationen beinhalten, gehen sie alle auf einen gemeinsamen Ursprung zurück: Eine geniale Idee für einen neuen Wirkstoff. - Wir beschleunigen Ihre biotechnologische Forschung auf dem Weg zu klinischen Studien
Angewandte Oekologie
Newsletter November 2025

In der diesjährigen Ausgabe des Newsletters Bereich Angewandte Oekologie möchten wir Ihnen unsere Forschungsarbeiten zum Thema »Boden« vorstellen. Lesen Sie in unserem ersten Beitrag über die Erfassung der Belastung landwirtschftlich genutzter Böden in Deutschland mit Chemikalien.
Das Projekt MetaInvert befasst sich mit der Entwicklung von Standards für genetisches Metabarcoding von Bodeninvertebratengemeinschaften.
Das von uns koordinierte Großprojekt »BioDive4Soil« untersucht, wie es um die biologische Vielfalt der Böden in Deutschland steht.
Wir freuen uns, Ihnen in unserem Portrait Dr. Sebastian Kühr, den Leiter unserer Attract-Nachwuchsgruppe »B-Pol« vorzustellen, die sich mit der Bioakkumulation von Polymerprodukten in Böden und Gewässern beschäftigt.
Aktuelle Forschungsangebote
The Power of Molecular Biology in Environmental Testing
Gewinnen Sie Einblicke in mikrobielle Gemeinschaften, Antibiotikaresistenzen und funktionelle Gendynamiken mit fortschrittlichen molekularen Werkzeugen für ökotoxikologische und biologische Abbaustudien.
Weitere Informationen: Molecular Biology in Environmental Testing
Species Sensitivity Distributions (SSD) with invertebrates
Prüfung von Standard- und Nicht-Standard-Wirbellosen in lenten und lotischen Testsystemen zur Bestimmung akuter und chronischer Endpunkte für einen SSD-Ansatz.
Weitere Informationen: SSD with invertebrates
Newsletter November 2024

Auf der SETAC-Jahrestagung 2024 in Sevilla leiste das Fraunhofer IME einen sichtbaren Beitrag: als Session Chairs im Organisationskommittee sowie als Autoren und Ko-Autoren von über 45 Vorträgen, Postern und Präsentationen. Lesen Sie im Newsletter November 2024 über unsere SETAC-Themen Polymerabbau, molekulare Wirkungen und Bewertungskonzepte sowie das Portrait über unsere in Sevilla präsentierende Doktorandin Marie Winter.
Zusätzlich finden Sie zur SETAC-Sondersitzung »Regulatorische Anforderungen für die wissenschaftliche Entwicklung« einen Bericht, den Sie per Link erreichen können.
Viel Freude beim Lesen: Newsletter NOV24
Weitere Informationen zu unseren Forschungsthemen auf der SETAC 2024 erhalten Sie auf dieser Webseite.
Newsletter November 2023

Das Fraunhofer IME aus Schmallenberg gibt im aktuellen Newsletter einen Einblick in neue Bewertungsverfahren und Erfassungsmethoden, die durch eine veränderte Wahrnehmung von Risiken erforderlich werden:
- Wenn Wasserflöhe Fische spüren: Fischeigene Kairomone vermitteln Schutzreflex bei dem Wasserfloh Daphnia magna
- WildOMICs: Erschließung des biologischen Potenzials der Umweltprobenbank des Bundes
- Versickerungsfähigkeit als Maß für die Mobilität von Stoffen bei der Einstufung als PMT/vPvM
- Im Porträt stellen wir unseren langjährigen Kollegen Uwe Boshof vor.
Viel Freude beim Lesen: Newsletter NOV23
Newsletter November 2022

Wir freuen uns, unseren Newsletter 2022 mit dem Schwerpunkt auf molekularanalytischen Methoden präsentieren zu dürfen.
Unsere Themen:
- TrendDNA: eine Zeitreise in die Biodiversität
- Toxikogenomische Methode zur Überwachung schädlicher Auswirkungen von Wasserproben aus Kläranlagen
- Verständnis des Bodenmikrobioms: Wo stehen wir? Identifizierung der fehlenden Testsysteme und Endpunkte
- Im Porträt: Dr. Bernd Göckener
Newsletter

November 2021
In dieser Ausgabe im neuen Design fokussieren wir uns auf die (Weiter-) Entwicklung von Richtlinien für spezielle Fragestellungen, die die Europäische Chemikalienregulation REACH benötigt. Wir stellen Ihnen folgende Forschungsprojekte aus dem Fraunhofer IME in Schmallenberg vor:
· Bewertung der Bioakkumulation von Nanomaterialien
· Experimentelle Charakterisierung von NER für die Persistenzbewertung
· Hormonaktive Substanzen als Bedrohung für Fischpopulationen
· Im Porträt: Dr. Karsten Schlich
November 2020
Mögliche Problemstoffe in der Umwelt erfordern Aufklärung hinsichtlich ihrer Exposition und Wirkung mittels angepasster Test- und Analyseverfahren, wie etwa für Futterinhalts- und -zusatzstoffe in der Aquakultur, für Kunststoffe in Folien für Landwirtschaft und Gartenbau, oder für das Spektrum per- und polyfluorierter Tensidverbindungen in menschlichem Blut.
Im Portrait stellen wir Dr. Steve Ayobahan vor, dessen Doktorarbeit und anschließende Tätigkeit in unserer Nachwuchsforschergruppe »Eco’n’Omics« dazu dient, in Zukunft die Produktion umweltverträglicherer Stoffe schon bei der Entwicklung zu unterstützen.
November 2019
Forschung widmet sich dem Unbekannten – und davon gibt es in der regulativen Stoffbewertung genug. Seien es in der Zusammensetzung unbekannte Gemische (UVCB-Substanzen), unbekannte Prozessierungsprodukte in der Herstellung von Lebensmitteln oder unbekannte Auswirkungen möglicherweise unbekannter Einflüsse auf Fischpopulationen - wir zeigen, wie wir mittels detektierender und systematisierender Ansätze zur Aufklärung und Bewertung beitragen. Außerdem stellen wir Ihnen mit Verena Kosfeld eine unserer Doktorandinnen vor, die in ihrer Arbeit die Forschungsfelder Bioakkumulation und Monitoring miteinander verbindet.
Sonderausgabe "Nano" Juni 2019
In diesem Jahr feiert das Fraunhofer IME seinen 60. Geburtstag – das sind 60 Jahre Forschung zur Umweltrisikoanalyse von Stoffen und zur Verbraucherexposition. Mit der Umweltwirkung von Nanomaterialien beschäftigen wir uns seit fast 20 Jahren – durch praktische Untersuchungen und durch Mitwirkung bei der Entwicklung internationaler Richtlinien. Mit unserem umfassenden Wissen
entwickeln wir Lösungsansätze und geben Antworten auf aktuelle Fragen. In diesem Newsletter finden Sie Beispiele sowie das Porträt von Dr. Kerstin Hund-Rinke, die die Forschung zur Ökotoxikologie von Nanomaterialien am Fraunhofer IME seit den Anfängen sehr erfolgreich vorantreibt.

Chronik 60 Jahre Fraunhofer in Schmallenberg
Zum Anlass unseres 60. Geburtstags haben wir auch eine Chronik in Form eines Flyers erstellt. Schauen Sie doch mal, wie sich das Institut aus Sicht des Standortes Schmallenberg als Keimzelle entwickelt hat.

Newsletter November 2018
Belastungen der Nahrung durch Chemikalien resultieren aus Transferprozessen. Zu deren Erforschung führen wir vielfältige Studien durch. Für die Aufklärung des Transfers von fluorierten Alkylsubstanzen über das Futter in Tierprodukte entwickeln wir Methoden zu deren vollständiger Erfassung. Zur Vorhersage von Metaboliten aus Pflanzenschutzmitteln, die über das Futter in Zuchtfische gelangen, haben wir eine Alternativmethode zum Tierversuch entwickelt. Außerdem erfahren Sie, wie wir die Bestimmung des Abbauverhaltens von Chemikalien im Boden verbessern, indem wir die Verlässlichkeit der Erfassung experimenteller Rahmenbedingungen untersuchen. Im Porträt stellen wir Ihnen Dr. Kerstin Derz, stellvertretende Leiterin der Abteilung Ökologische Chemie, vor.

Newsletter November 2017
Das Umweltrisiko von Chemikalien analysieren und die Qualität von Umweltmedien bewerten – das sind zentrale Aufgaben der Angewandten Oekologie am Fraunhofer IME. In dieser Ausgabe berichten wir über ein neuartiges Testsystem für empfindliche Fließgewässerorganismen und den Nachweis von Rattengift in deutschen Binnengewässern mit einer im Rahmen des Umweltprobenbank-Monitorings entwickelten Multidetektionsmethode. Am Beispiel der Abwasserreinigung gehen wir der Frage nach, ob aus der chemischen Zusammensetzung auf die Ökotoxizität von Nanomaterialien geschlossen werden kann. Zudem stellen wir Ihnen Matthias Teigeler vor, der unser weltweit anerkanntes Fischlabor leitet.

Newsletter November 2016
Chemikalien gelangen über Produktion, Transport, Nutzung und Entsorgung von Verbrauchsgütern in die Umwelt und von dort in Lebensmittelrohstoffe. Die Nachweisgrenzen sinken ständig, immer mehr Stoffe können in immer geringeren Konzentrationen festgestellt werden. Im Spannungsfeld zwischen industrieller Produktion und gesetzlicher Regulation sind wir an der Entwicklung vieler internationaler Testverfahren zur Stoffbewertung beteiligt: Beispiele dazu finden Sie in dieser ersten Ausgabe des Newsletters der Angewandten Oekologie. Außerdem stellen wir Ihnen Dr. Burkhard Knopf vor, der im Rahmen der Umweltprobenbank Schadstoffbelastungen retrospektiv erfasst.
Higher Tier Aquatic Risk Assessment

Standard Risikobewertungen wurden zu unserem Schutz entworfen, sind jedoch nicht zwanghaft realistisch. Es gibt mehrere Möglichkeiten, diese Bewertungen mithilfe von Studien auf höherer Ebene (sogenannte higher tier Studien) zu verfeinern. Wir konzipieren und führen solche Studien unter GLP-Bedingungen durch und bewerten aquatische Effekte, um realistischere Effektdaten zu liefern und die Unsicherheiten bei der Extrapolation auf eine Feldsituation zu reduzieren. Notwendige Verbleibs- und Expositionsanalysen werden in enger Zusammenarbeit mit unseren chemischen Abteilungen durchgeführt.
Nanomaterialien - Verhalten, Verbleib und Wirkung

Nanomaterialien erobern den europäischen Markt in einer schnell wachsenden Anzahl von Produkten, die sowohl für die Industrie als auch für private Verbraucher verfügbar sind. Sie bieten ein breites Spektrum an technischen und kommerziellen Möglichkeiten, z. B. als Inhaltsstoffe von Lebensmitteln, Pharmazeutika und Kosmetika. Die in den letzten Jahren in der wissenschaftlichen Literatur veröffentlichten Ergebnisse legen jedoch nahe, dass einige Nanomaterialien aufgrund gefährlicher Eigenschaften, Anlass zu Gesundheits- und Sicherheitsbedenken hinsichtlich Menschen und Organismen in der Umwelt geben könnten. Obwohl der Entwurf der Leitlinien von den zuständigen Behörden immer noch nicht weit genug entwickelt ist, sind wir in der Lage ein umfassendes Spektrum experimenteller Methoden zur Verfügung zu stellen, die das Verhalten, den Verbleib und die Auswirkungen von Nanomaterialien so zu prüfen und zu bewerten, dass sie den regulatorischen Anforderungen voll entsprechen.
 Fraunhofer-Institut für Molekularbiologie und Angewandte Oekologie IME
Fraunhofer-Institut für Molekularbiologie und Angewandte Oekologie IME



