
Stärke spielt als nachwachsender Rohstoff in ganz unterschiedlichen Industriezweigen eine bedeutende Rolle. Das breite Spektrum der stofflichen Nutzung im Non-Food Sektor reicht von Papier, Wellpappe und Farben über Werk- und Verbundwerkstoffe bis hin zu Kosmetika, Biokunststoffen, Pharmazeutika, Medizinprodukten und sogar Textilien.
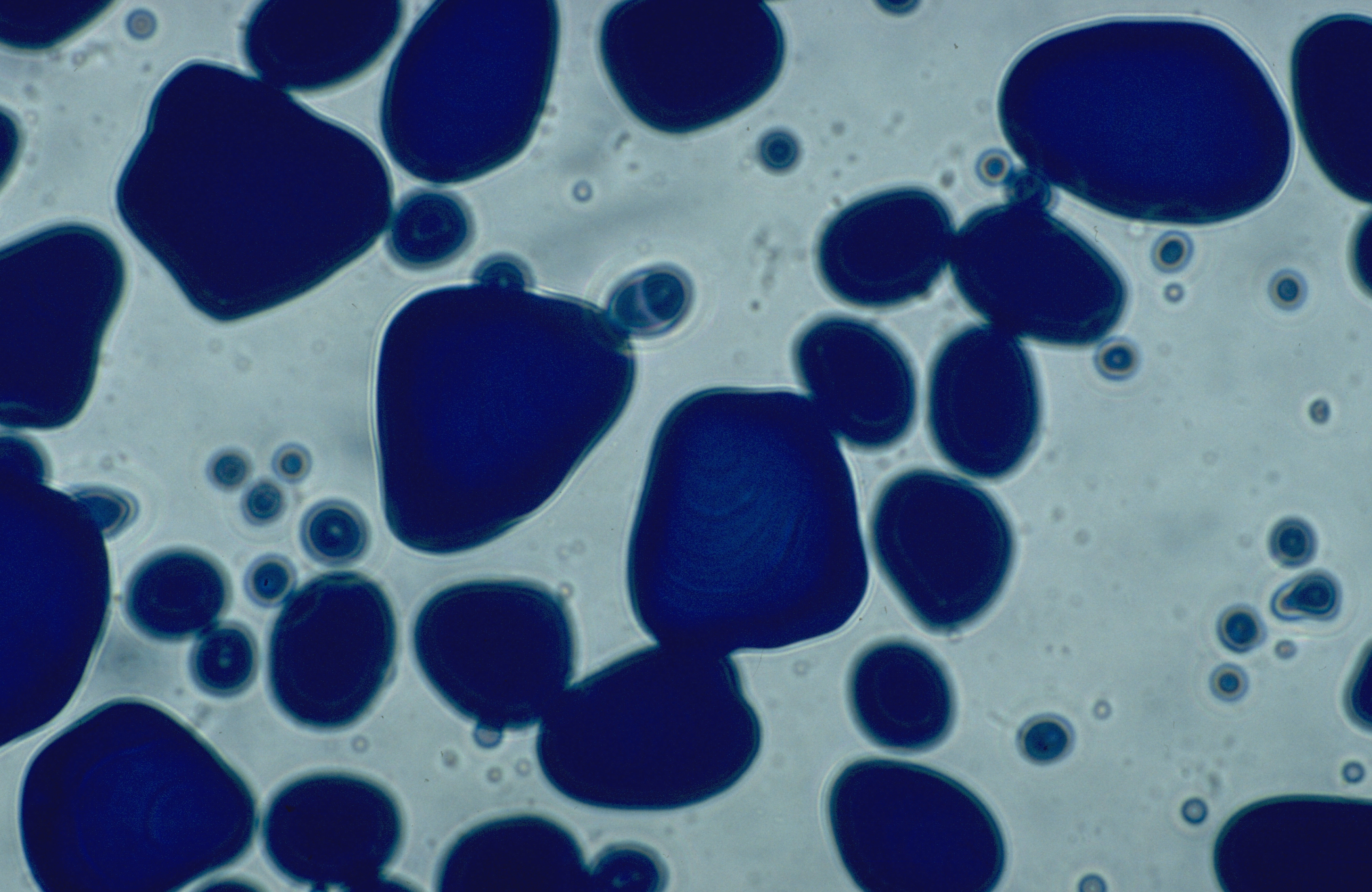
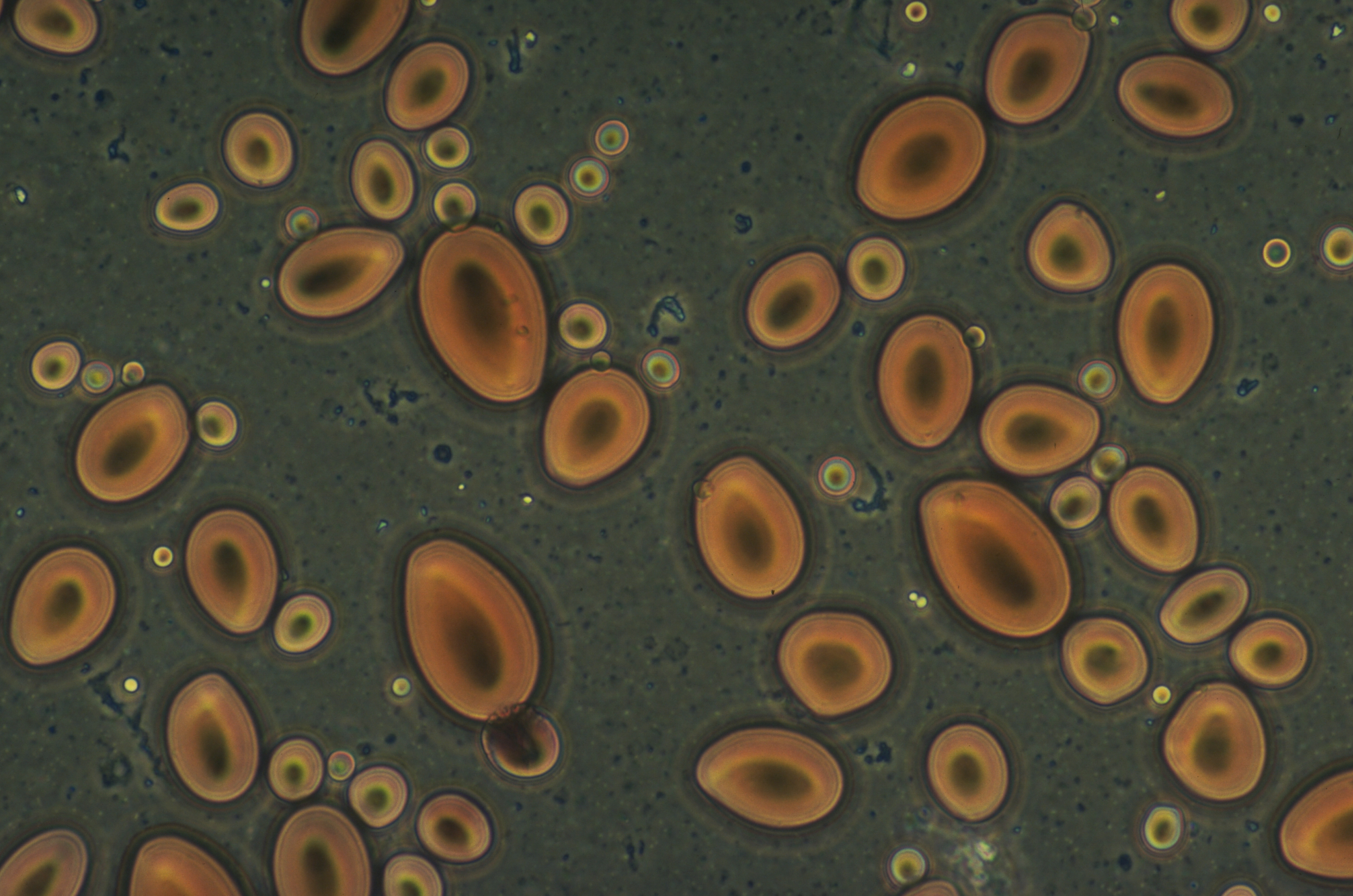
Stärke setzt sich aus zwei Komponenten zusammen: Den linearen Ketten der Amylose und den verzweigten Ketten des Amylopektins. Beide Polymere bestehen aus Glukosemolekülen, die auf unterschiedliche Weise miteinander verknüpft sind. Die Bestandteile unterscheiden sich deutlich in ihren physikalisch-chemischen Eigenschaften: Amylopektin wirkt verdickend, Amylose dagegen gelierend. In vielen technischen Anwendungen, wie z.B. in der Papier-, Garn- und Klebstoffindustrie, wird nur Amylopektin benötigt und Amylose ist unerwünscht, da sie in vielen Anwendungen stört. Eine Trennung von Amylopektin und Amylose ist zwar prinzipiell möglich, aber mit einem extrem hohen Energieaufwand verbunden und daher unwirtschaftlich. Konventionell wird die gelierende Wirkung der Amylose durch chemische Modifizierung vor der Anwendung reduziert. Auch dieser Prozess ist mit einem erhöhten Energie- und Wasserverbrauch verbunden.
Stärke kommt in nahezu allen Pflanzen vor.
Für industrielle Zwecke werden in Deutschland 3,7 Millionen Tonnen Weizen, Kartoffeln und Mais als Rohstoffquelle angebaut. Kartoffelstärke unterscheidet sich in einigen Punkten wesentlich von Mais- oder Weizenstärke. Die höhere Reinheit der Stärke, die höhere Viskosität und die damit verbundene höhere Bindekraft der Stärkepasten prädestinieren Kartoffelstärke für zahlreiche Anwendungen. Deshalb wählten die Forscher des Fraunhofer IME die Kartoffel aus, um ihre Stärkebiosynthese so zu verändern, dass nur noch Amylopektin gebildet wird. Aus der Forschung mehrerer Gruppen weltweit wussten sie, dass dazu ein Gen ausgeschaltet werden muss. Um dieses Ziel zu erreichen, nutzten die Forscher die TILLING-Technologie. TILLING steht für »Targeting Induced Local Lesions IN Genomes«. Zunächst behandelten die Forscher Kartoffelsamen mit Ethylmethansulfonat, einer Substanz, die seit langem in der Züchtung eingesetzt wird. Sie erzeugt zufällige Punktmutationen im Erbgut. Im Blattgewebe der daraus gezogenen Pflanzen sucht man dann nach der gewünschten Mutation, die die Amylose-Synthese unterbindet. Möglich wird dies durch die enormen Fortschritte in der molekulargenetischen Analytik, mit der das Erbgut von Tausenden von Keimlingen relativ schnell auf Mutationen untersucht werden kann. 2.748 Keimlinge wurden untersucht, bis diejenigen identifiziert waren, die die gewünschten Mutationen in einer Kopie des Amylose-Gens aufwiesen.
Die Züchtung dieser vielversprechenden Kandidaten erfolgte dann beim Kooperationspartner BioPlant, der durch Kreuzungen weitere Eigenschaften wie Resistenz und Ertrag optimierte. Die Forscher des Fraunhofer IME analysierten das Erbgut jeder Pflanzengeneration. Nur Kartoffeln mit jeweils zwei defekten Kopien des Amylose-Gens wurden weiter gezüchtet, um die Mutation zu erhalten. Die besten von ihnen wurden schließlich gekreuzt. Ein Sechsunddreißigstel ihrer Nachkommen trägt dann vier defekte Amylose-Gen-Kopien und damit die Voraussetzung, nur noch Amylopektin zu bilden.
Seitdem stehen diese Kartoffeln Jahr für Jahr auf den Feldern der Vertragslandwirte.
 Fraunhofer-Institut für Molekularbiologie und Angewandte Oekologie IME
Fraunhofer-Institut für Molekularbiologie und Angewandte Oekologie IME