Pflanzenschädlinge und Krankheitserreger stellen weltweit eine große Bedrohung für die Pflanzenproduktion dar. Diese hat in den letzten Jahren dramatisch zugenommen. Globalisierung, Handel und Klimawandel spielen hierbei eine wichtige Rolle. Die FAO schätzte im Jahr 2019, das jährlich zwischen 20 und 40 Prozent der weltweiten Pflanzenproduktion durch Schädlinge verloren gehen. So kosten Pflanzenkrankheiten die Weltwirtschaft jedes Jahr rund 220 Milliarden US Dollar. Die Schäden werden durch Krankheitserreger aus der Gruppe der Bakterien, Pilze, Insekten und Viren hervorgerufen.
Klassische Methoden zur Identifizierung der Pflanzenpathogene sind die Beobachtung von Symptomen sowie die Kultivierung der Schaderreger für die morphologische Identifizierung mit Hilfe der Mikroskopie. Heutzutage weit verbreitete Diagnoseverfahren basieren auf immunologischen Technologien wie zum Beispiel dem Enzymimmunoassay (ELISA) oder dem Lateral Flow Immunoassay (LFIA). In Laboren setzen sich verstärkt Nukleinsäure-basierte Methoden zum Nachweis und zur Identifizierung der Krankheitserreger durch. Die Polymerase-Kettenreaktion (PCR) und ihre Varianten sind in der Regel sehr spezifisch und sensitiv, zudem relativ schnell und kostengünstig, weisen aber dennoch einige Nachteile auf, da eine spezielle Ausrüstung und geschultes Personal erforderlich sind.
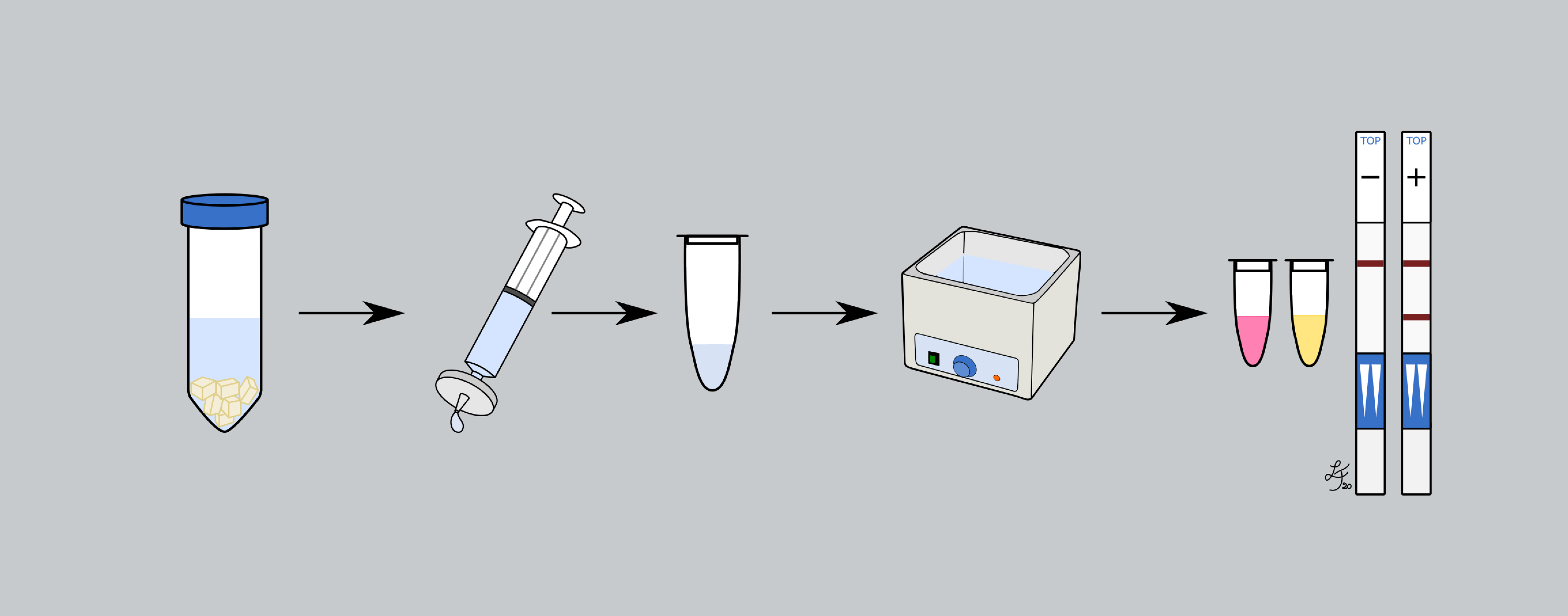
Um Pflanzenkrankheiten und die Ausbreitung der Pathogene in neue Gebiete zu kontrollieren und möglichst zu verhindern, ist es jedoch zwingend erforderlich, Methoden zur Früherkennung, die vor-Ort im Feld eingesetzt werden können, zu entwickeln. Für die Realisierung solcher Point-of-Care Diagnostik ist das Zusammenspiel folgender Eigenschaften Bedingung: Hohe Spezifität, Empfindlichkeit, Reproduzierbarkeit, Schnelligkeit, Kosteneffizienz und Multiplex-Nachweisfähigkeit gepaart/kombiniert mit einfacher Handhabung, so dass wenig geschultes Personal die Tests durchführen kann ohne spezielle Laborgeräte nutzen zu müssen.
Technologien, die auf der isothermen Amplifikation der Nukleinsäuren basieren, wie die schleifenvermittelte isotherme Amplifikation (loop-mediated isothermal amplification LAMP) erfüllen optimal diese Anforderungen an die Point-of-Care Diagnostik.
Daher fokussiert die Abteilung Funktionelle und Angewandte Genomik die FuE Arbeiten zur PoC-Diagnostik von Pflanzenpathogenen auf diese Technologie.
 Fraunhofer-Institut für Molekularbiologie und Angewandte Oekologie IME
Fraunhofer-Institut für Molekularbiologie und Angewandte Oekologie IME