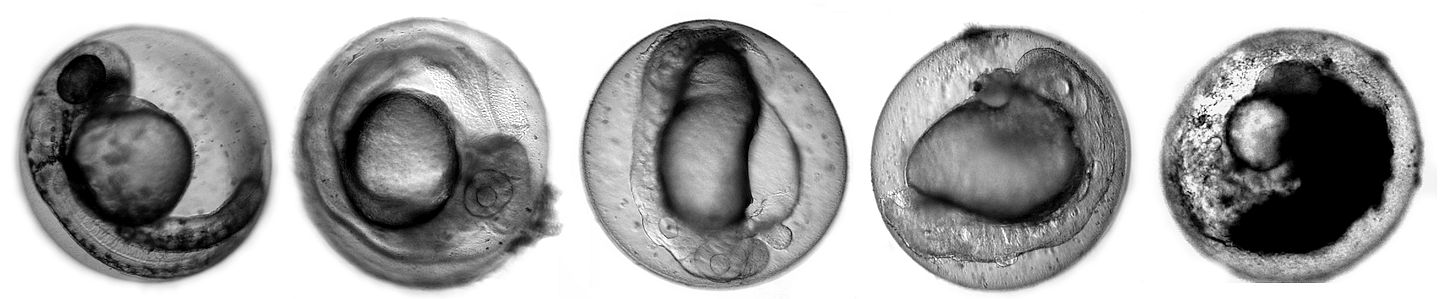
Ersatz von Tierversuchen

Akute und Langzeittoxizitätstests mit Fischen in der Umweltrisikobewertung sorgen - neben den für die Sicherheitsprüfung von Produkten für die menschliche Gesundheit vorgeschriebenen Tests an Nagern - für eine noch immer steigende Zahl an Tierver-suchen. Weitere gesetzlich vorgeschriebene Studientypen zur Gewährleistung von Umwelt- und Verbraucherschutz sind in Planung. Aktuell wird für die Pflanzenschutzmittelzulassung die Erweiterung des Nutztierspektrums für Metabolismusstudien durch Zuchtfische (Regenbogenforelle, Karpfen) umgesetzt.
Der Bedarf an Ersatz- und Ergänzungsmethoden ist dementsprechend groß, die Verfügbarkeit von anerkannten, leistungsfähigen Alternativmethoden ist jedoch bislang sehr beschränkt. Das Fraunhofer IME engagiert sich daher bei der Entwicklung von Alternativmethoden mit Fischeiern, Zellversuchen und wirbellosen Tieren.
Der Fischembryo-Toxizitätstest (FET) oder kurz Fischeitest gemäß DIN 38415-T6 ersetzt seit 2005 in Deutschland den akuten Fischtest bei der gesetzlich vorgeschriebenen Abwasseruntersuchung. International wird hinsichtlich der Bewertung und Zulassung von Chemikalien intensiv diskutiert, ob der FET als Alternativ- und Ergänzungsmethode für die zur Risikoabschätzung vorgeschriebenen akuten Fischtests eingesetzt werden kann. Der FET trägt den Grundsätzen der 3Rs Rechnung, da Fischembryonen gemäß geltender europäischer Verordnung (Richtlinie 2010/63/EU) nicht als schützenswertes Tier angesehen werden.
In einem aktuellen Kooperationsprojekt mit der Universität Bern wird derzeit untersucht, ob Metabolismusstudien in Zellkulturen in Kombination mit kinetischer Modellierung Bioakkumulationsstudien mit Fischen ersetzen können. GLeichzeitig werden Ersatzmethoden mit Gammariden entwickelt.
Durch die Weiterentwicklung Mechanismen-spezifischer qualitativer Struktur- Wirkungsbeziehungen (QSARs) wird der Bedarf zur Durchführung von Tierversuchen fokussiert.
Ausgewählte Publikationen
Hering I, Eilebrecht E, Parnham MJ, Günday-Türeli N, Türeli AE, Weiler M, Schäfers C, Fenske M, Wacker MG:
Evaluation of potential environmental toxicity of polymeric nanomaterials and surfactants. Environmental Toxicology and Pharmacology (2020) 76:103353
(DOI: 10.1016/j.etap.2020.103353)
Delov, V., Muth-Köhne, E., Schäfers, C., Fenske, M.:
Transgenic fluorescent zebrafish Tg(fli1:EGFP)y1 for the identification of vasotoxicity within the zFET. Aquatic Toxicology 150 (2014) 189–200
(DOI: 10.1016/j.aquatox.2014.03.010)
Schiller, V., Zhang, X., Hecker, M., Schäfers, C., Fischer, R., Fenske, M.:
Species-specific considerations in using the fish embryo test as an alternative to identify endocrine disruption. Aquatic Toxicology 155 (2014) 62–72 (DOI: 10.1016/j.aquatox.2014.06.005)
Muth-Köhne, E., Wichmann, A., Delov, V., Fenske, M.:
The classification of motor neuron defects in the zebrafish embryo toxicity test (ZFET) as an animal alternative approach to assess developmental neurotoxicity. Neurotoxicology and Teratology 34 (2012) No. 4: 413 - 424 (DOI: 10.1016/j.ntt.2012.04.006)
Schiller, V., Wichmann, A., Kriehuber, R., Schäfers, C., Fischer, R., Fenske, M.:
Transcriptome alterations in zebrafish embryos after exposure to environmental estrogens and anti-androgens can reveal endocrine disruption. Reproductive Toxicology 42 (2013) 210-223 (DOI: 10.1016/j.reprotox.2013.09.003)
Schiller, V., Wichmann, A., Kriehuber, R., Muth-Köhne, E., Giesy, J. P., Hecker, M., Fenske, M.:
Studying the effects of genistein on gene expression of fish embryos as an alternative testing approach for endocrine disruption. Comparative Biochemistry and Physiology. Part C: Toxicology & Pharmacology 157 (2013) No. 1: 41-53 (DOI: 10.1016/j.cbpc.2012.09.005)
Turner, C., Sawle, A., Fenske, M., Cossins, A.:
Implications of the solvent vehicles dimethylformamide and dimethylsulfoxide for establishing transcriptomic endpoints in the zebrafish embryo toxicity test. Environmental Toxicology and Chemistry 31 (2012) No. 3: 593-604 (DOI: 10.1002/etc.1718/abstract)
 Fraunhofer-Institut für Molekularbiologie und Angewandte Oekologie IME
Fraunhofer-Institut für Molekularbiologie und Angewandte Oekologie IME